
L’aria
Ogni entità in possesso di massa e dimensioni spaziali viene definita materia ed è costituita da particelle dette
molecole
. È possibile trovare la materia nelle seguenti forme:
•
solida
, ha volume e forma propria: le molecole sono strettamente legate le une alle altre;
•
liquida
, con un proprio volume ma non una forma: le molecole assumono la forma del recipiente che le contiene;
•
gassosa
, la materia non ha una forma e un volume proprio: le molecole sono libere di muoversi al punto che la
loro distanza e posizione varia in continuazione.
In questa sezione ci soffermiamo sulla caratteristica propria dei gas detta
compressione
, per guidarci nella com-
prensione utilizziamo come esempio la pompa della bicicletta.
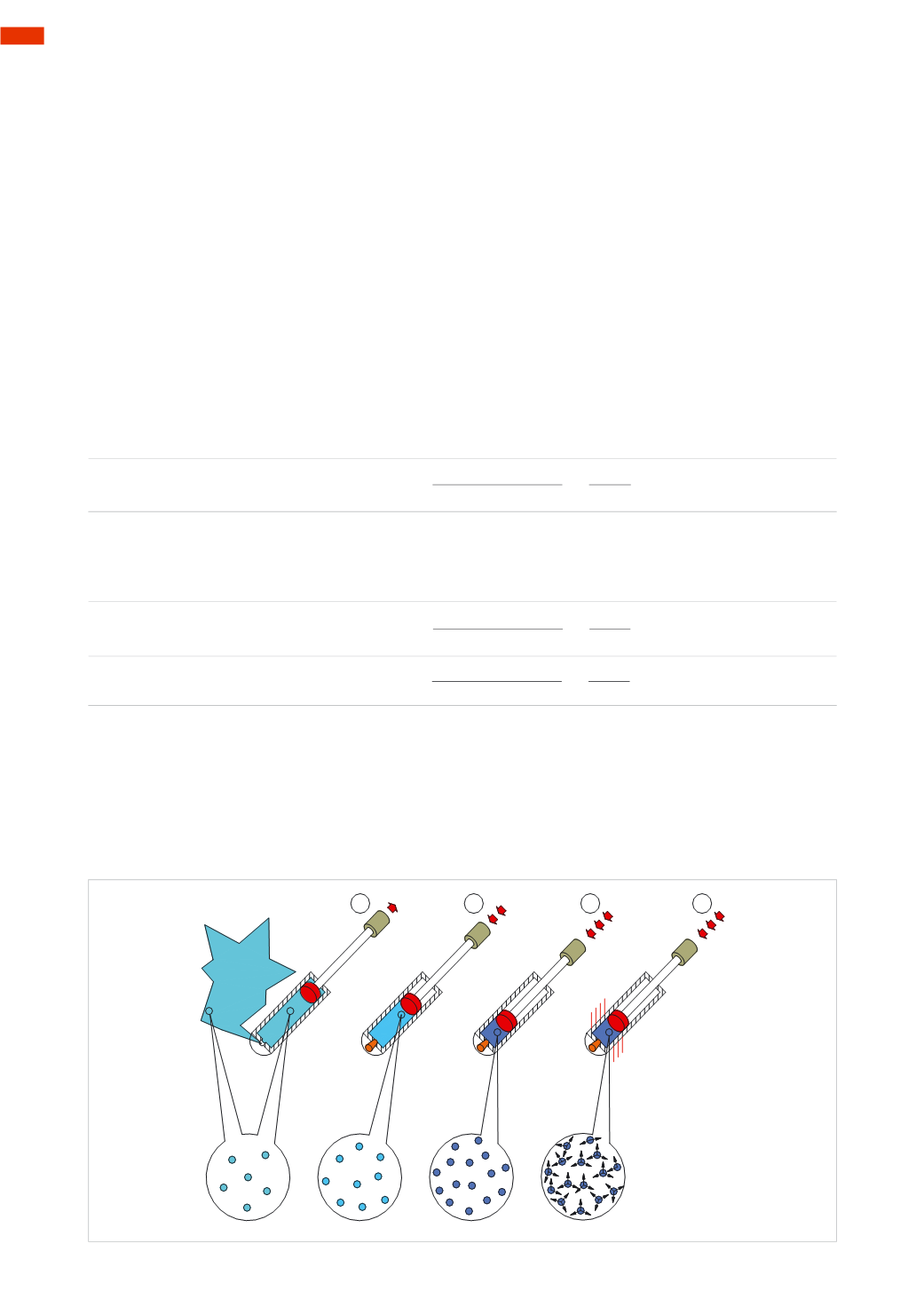
Figura 1
Pos. 1:
attraverso il foro posto all’estremità della pompa, l’aria esterna viene
aspirata
nel cilindro (o camera)
mediante il pistone; di conseguenza, il suo volume e la sua forma coincidono con le dimensioni del contenitore,
ossia della camera.
Pos. 2:
chiudendo il foro della pompa ed esercitando una pressione sul pistone, l’aria si
comprime
diminuendo il
volume occupato.
Pos. 3:
aumentando ulteriormente la pressione sul pistone, il volume occupato dall’aria diminuisce. È possibile
osservare che le molecole, se soggette ad un’azione di compressione, sono costrette a posizionarsi in uno spazio
sempre inferiore.
Ipotizziamo che il numero totale di molecole contenute nella pompa sia 900 e che la camera della pompa abbia
un volume di 150
cm³
; calcoliamo il numero di molecole presenti per ogni
cm³
:
n° di molecole per cm
3
=
n° tot di molecole
= 900 =
6
volume
150
Riducendo lo spazio volumetrico, l’aria si comprime e il numero di molecole per
cm³
aumenta.
Portando il volume da 150 a 100
cm³
e successivamente a 60
cm³,
calcoliamo il numero di molecole presenti:
n° di molecole per cm
3
=
n° tot di molecole
= 900 =
9
volume
100
n° di molecole per cm
3
=
n° tot di molecole
= 900 =
15
volume
60
Possiamo concludere che con la compressione dell’aria, lasciando invariato il numero di molecole totali,
aumenta
il numero di molecole per
cm³
.
Figura 1
Pos. 4:
la compressione ha la proprietà di influenzare la temperatura del gas, le molecole gassose sono sempre
in movimento secondo traiettorie rettilinee e si urtano vicendevolmente tra loro e con le pareti del contenitore.
Diminuendo il volume, le molecole si avvicinano, aumentano la velocità dei loro movimenti e il numero degli urti
causando l’
aumento della temperatura
.
1
2
3
4
Aria Libera
Fig. 1
1
12
CAMOZZI
>
LA FISICA

















