
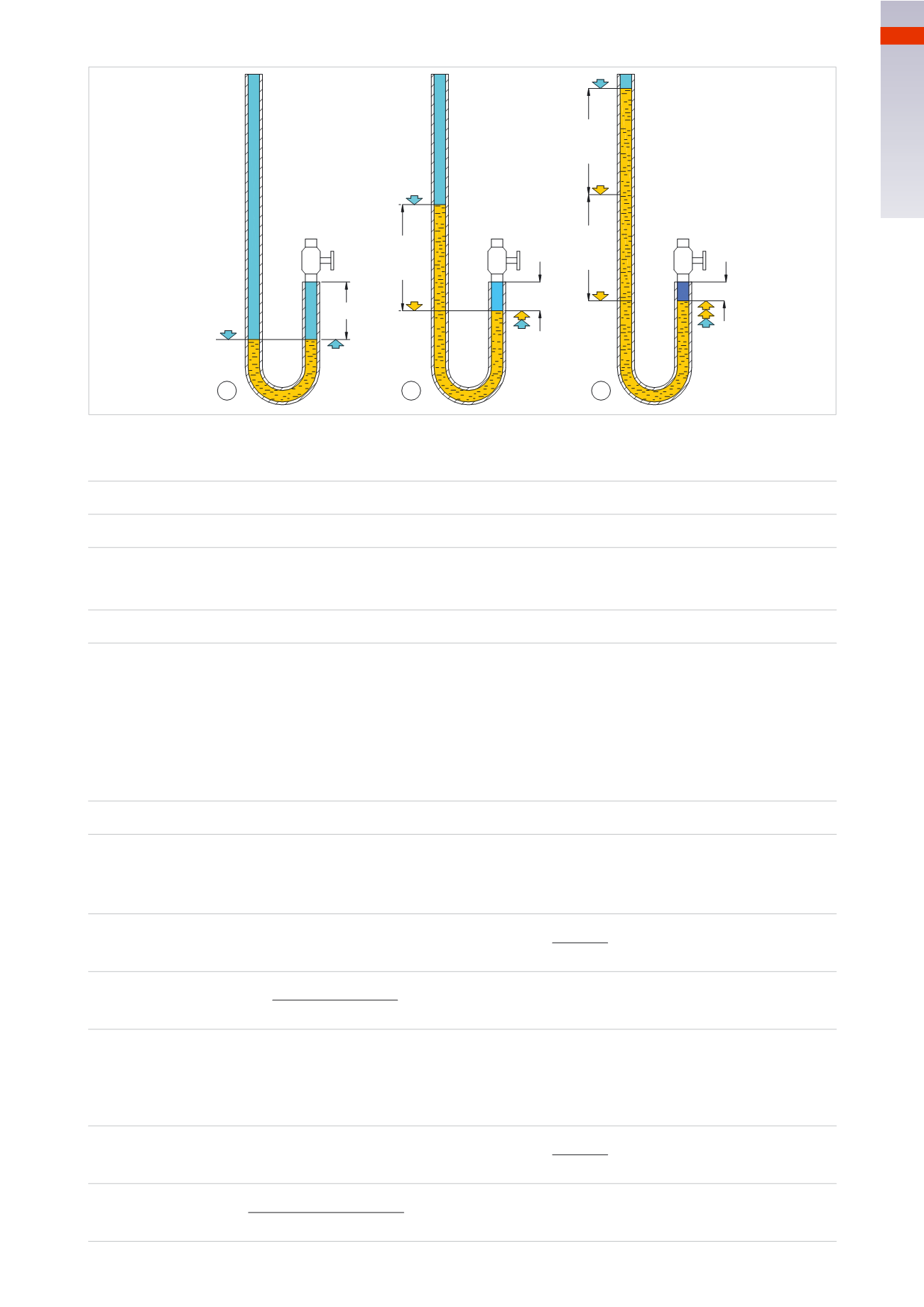
LA FISICA
X
1/2 X
1
2
1/3 X
3
76 cm
76 cm
76 cm
Fig. 8
Attribuiamo dei valori letterali alle variabili:
Pressione iniziale
(Pos. 1) =
p
i
Pressione finale (Pos. 2) =
p
f
Volume iniziale
(Pos.1) =
V
i
Volume finale (Pos.2) =
V
f
Dall’esperienza descritta risulta che:
p
i
: p
f
=
V
f
: V
i
p
i
* V
i
=
p
f
* V
f
Questa proprietà studiata dal chimico irlandese Robert Boyle (1627-1691) è enunciata nella legge che porta il suo
nome:
il volume occupato da una data massa di gas, tenuta a temperatura costante, è inversamente proporzio-
nale alla pressione a cui è sottoposta
.
Ossia, al raddoppiare della pressione il volume si dimezza; se la pressione diventa un terzo, il volume della massa
gassosa triplica ecc.
Se con
p
si indica la pressione del gas e con
V
il suo volume, la legge di Boyle si può esprimere anche con la formula:
p * V
=
costante
Esempio 1
: un serbatoio con volume
V
i
= 2
m
3
è sottoposto alla pressione
p
i
= 5
bar
. Quale sarà il suo volume
alla pressione atmosferica, tenendo costante la temperatura ?
p
i
* V
i
=
p
f
* V
f
V
f
=
V
i
* p
i
p
f
2
[cm
3
]
* 5
[bar]
= 10
cm
3
V
f
=
10
cm
3
1
[bar]
Esempio 2
: una massa d’aria subisce una pressione
p
i
= 2,5
bar
ed occupa un volume
V
i
= 0,5
m³
a
temperatura costante, un aumento di pressione riduce il volume
V
f
= 0,1
m³
.
Quanto vale la nuova pressione
p
f
?
p
i
* V
i
=
p
f
* V
f
p
f
=
V
i
* p
i
V
f
2,5
[bar]
* 5
[m
3
]
= 12,5
bar
p
f
=
12,5
bar
0,1
[m
3
]
1
17
CAMOZZI
>
LA FISICA

















